


在線咨詢

聯系電話
400-182-9001
置頂

藥包材、生產工藝組件和SUS
品質賦能平臺 聚力價值信任
藥包材、生產工藝組件和SUS
醫用材料研究平臺
藥包材&生產工藝系統相容性研究
2、生產過程組件相容性研究,包括:硅膠管、過濾器、連接組件、玻璃組件、不銹鋼組件、儲液袋、攪拌袋。
3、醫療器械材料化學特性,包括氣體管路測試、化學表征可瀝濾物等材料化學特性研究。
藥包材& 生產工藝系統相容性研究
業務范圍
1、成品和原液藥包材相容性研究,包括:西林瓶、安瓿瓶、膠塞、預灌封、滴眼劑瓶、塑料瓶、細胞凍存袋、塑料桶、不銹鋼桶。
2、生產過程組件相容性研究,包括:硅膠管、過濾器、連接組件、玻璃組件、不銹鋼組件、儲液袋、攪拌袋。
3、醫療器械材料化學特性,包括氣體管路測試、化學表征可瀝濾物等材料化學特性研究。
4、給藥器具相容性研究:包括輸液器,注射器,留置針,一次性給藥適配器等給藥器的相容性研究。
英格爾優勢
團隊專業:成熟的相容性研究團隊,超過數百例的項目研究經驗,有各種品種的數據庫積累,豐富的項目申報經驗,熟悉USPEAMAPQRIBPOGICHISO 10993和國內的所有相關法規,結合最新國內政策及藥學專家數年的研究經驗來制定專屬相容性研究方案方案設計符合NMPA、FDA EMEA等申報要求。
儀器一流:配置一整套最新、敏度高、帶審計追蹤功能的儀器設備(包括但不限于AB SCIEX LC-MS-MS、PerkinLmer ICP-MS/OES、安捷倫HPLC-FID/DAD、GC-MS-MS、HS-GC-MS等)
包材風險分類
不同給藥途徑的風險升級 | 制劑與包裝組件發生相互作用的可能性 | ||
高 | 中 | 低 | |
最高 | 吸入氣霧劑及噴霧劑 | 注射液和注射用混懸液 吸入溶液劑 | 無菌粉末和注射用粉末 吸入粉霧劑 |
高 | 透皮軟膏及貼劑 | 眼用溶液及混懸液 鼻用氣霧劑及噴霧劑 | |
低 | 局部用溶液及混懸液 局部及舌下用氣霧劑 口服溶液及混懸1劑 | 口服片劑和口服(硬和軟明膠)膠囊 局部用粉劑 口服散劑 | |
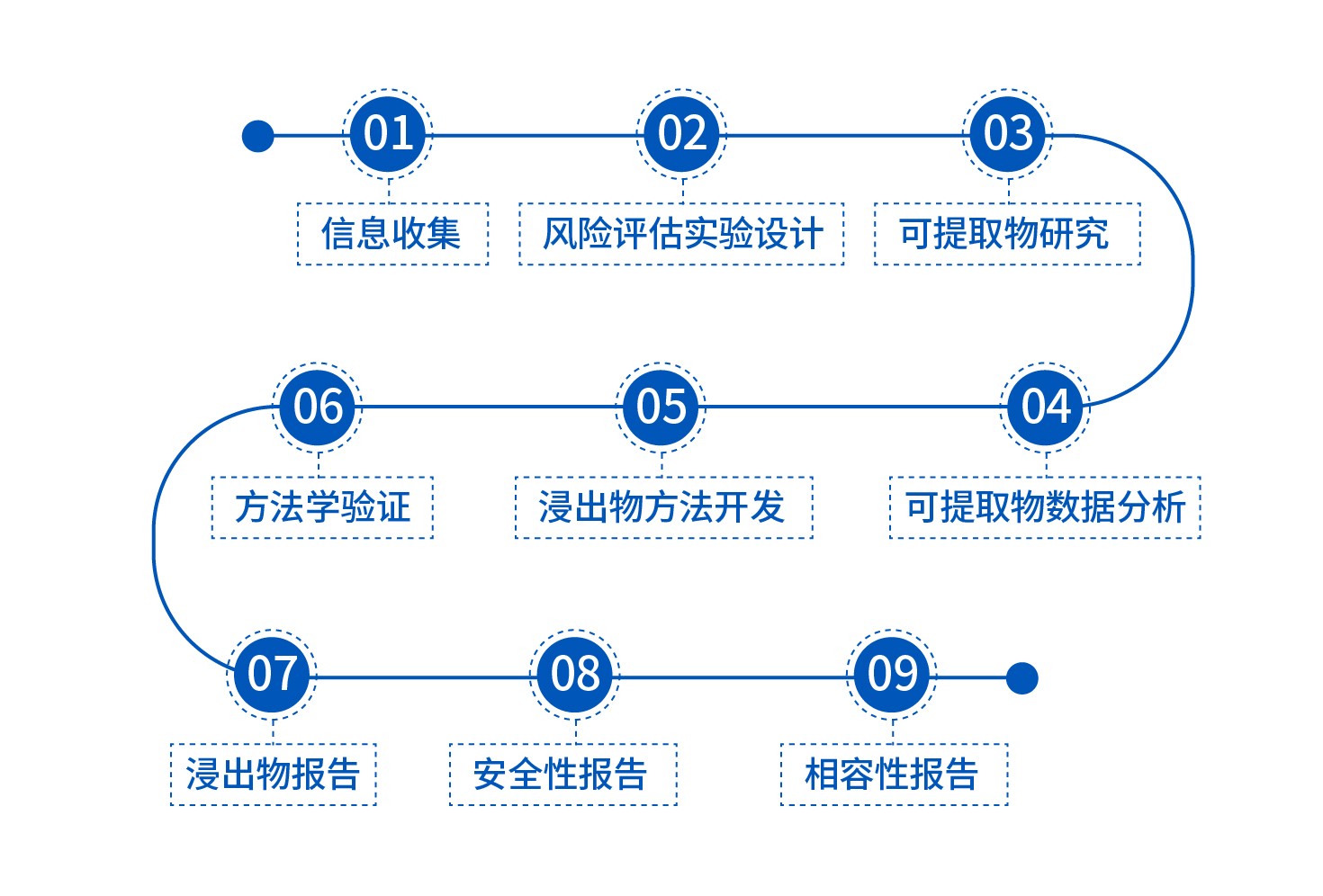
藥包材相容性流程研究
1. 信息的收集評估:
根據項目申請單的包裝材料配方信息、生產工藝信息以及與藥品有關的關鍵參數(如規格、給藥途徑、日最大攝入量等)為客戶定制相容性研究方案。
2. 提取實驗和模擬試驗:
模擬、提取試驗會充分考慮藥品在生產、貯存、運輸以及使用過程中可能面臨的極端條件進行閾值的計算、模擬液和模擬條件的選擇、以及對可提取物方法的開發,幫助客戶篩選包材。
3. 方法學設計與驗證:
根據中國藥典、美國藥典和國內相關指導原則,對檢測方法進行方法學驗證,內容包含但不限于專屬性、線性、系統適用性、準確度、精密度(重復性和中間精密度)、檢出限和定量限。
4. 浸出物(遷移)試驗:
針對加速、長期穩定性樣品的測試,根據NMPA藥品研發試驗記錄規定規范原始數據管理。
5. 毒理學安全性評估:
參考毒理學數據庫如DEREK, TOXNET, HSDB, TOXLINE等,由毒理學專家完成包括建模、數據庫查詢、文獻查詢、閾值計算等工作,從而得到完整的毒理學評估報告。
6. 結論:
綜合可提取物研究和浸出物研究結果,并參考毒理學評估結果,給出最終的相容性研究結論。
藥包材相容性研究流程圖
參考的國內法規如下
《化學藥品注射劑與藥用玻璃包裝容器相容性研究技術指導原則(試行)》
《化學藥品注射劑與塑料包裝材料相容性研究技術指導原則(試行)》
《化學藥品注射劑與藥用彈性體相容性研究技術指導原則(試行)》
《YBB00142002-2015藥品包裝材料與藥物相容性試驗指導原則》
《中國藥典》2015版等
PQRI
ICH Q3D
USP 1663& USP1664
USP 665& USP 1665
常見問題
包裝材料和藥品種類多樣、復雜法規要求理解不透徹,無法設計出一套完整的解決方案溶出量極低且體系復雜,儀器的高靈敏度和高選擇性并重
藥包材、生產工藝組件和SUS
醫用材料研究平臺
藥包材&生產工藝系統相容性研究
2、生產過程組件相容性研究,包括:硅膠管、過濾器、連接組件、玻璃組件、不銹鋼組件、儲液袋、攪拌袋。
3、醫療器械材料化學特性,包括氣體管路測試、化學表征可瀝濾物等材料化學特性研究。


藥包材、生產工藝組件和SUS
醫用材料研究平臺
藥包材&生產工藝系統相容性研究
2、生產過程組件相容性研究,包括:硅膠管、過濾器、連接組件、玻璃組件、不銹鋼組件、儲液袋、攪拌袋。
3、醫療器械材料化學特性,包括氣體管路測試、化學表征可瀝濾物等材料化學特性研究。
藥包材& 生產工藝系統相容性研究
業務范圍
1、成品和原液藥包材相容性研究,包括:西林瓶、安瓿瓶、膠塞、預灌封、滴眼劑瓶、塑料瓶、細胞凍存袋、塑料桶、不銹鋼桶。
2、生產過程組件相容性研究,包括:硅膠管、過濾器、連接組件、玻璃組件、不銹鋼組件、儲液袋、攪拌袋。
3、醫療器械材料化學特性,包括氣體管路測試、化學表征可瀝濾物等材料化學特性研究。
4、給藥器具相容性研究:包括輸液器,注射器,留置針,一次性給藥適配器等給藥器的相容性研究。
英格爾優勢
團隊專業:成熟的相容性研究團隊,超過數百例的項目研究經驗,有各種品種的數據庫積累,豐富的項目申報經驗,熟悉USPEAMAPQRIBPOGICHISO 10993和國內的所有相關法規,結合最新國內政策及藥學專家數年的研究經驗來制定專屬相容性研究方案方案設計符合NMPA、FDA EMEA等申報要求。
儀器一流:配置一整套最新、敏度高、帶審計追蹤功能的儀器設備(包括但不限于AB SCIEX LC-MS-MS、PerkinLmer ICP-MS/OES、安捷倫HPLC-FID/DAD、GC-MS-MS、HS-GC-MS等)
包材風險分類
不同給藥途徑的風險升級 | 制劑與包裝組件發生相互作用的可能性 | ||
高 | 中 | 低 | |
最高 | 吸入氣霧劑及噴霧劑 | 注射液和注射用混懸液 吸入溶液劑 | 無菌粉末和注射用粉末 吸入粉霧劑 |
高 | 透皮軟膏及貼劑 | 眼用溶液及混懸液 鼻用氣霧劑及噴霧劑 | |
低 | 局部用溶液及混懸液 局部及舌下用氣霧劑 口服溶液及混懸1劑 | 口服片劑和口服(硬和軟明膠)膠囊 局部用粉劑 口服散劑 | |
藥包材相容性流程研究
1. 信息的收集評估:
根據項目申請單的包裝材料配方信息、生產工藝信息以及與藥品有關的關鍵參數(如規格、給藥途徑、日最大攝入量等)為客戶定制相容性研究方案。
2. 提取實驗和模擬試驗:
模擬、提取試驗會充分考慮藥品在生產、貯存、運輸以及使用過程中可能面臨的極端條件進行閾值的計算、模擬液和模擬條件的選擇、以及對可提取物方法的開發,幫助客戶篩選包材。
3. 方法學設計與驗證:
根據中國藥典、美國藥典和國內相關指導原則,對檢測方法進行方法學驗證,內容包含但不限于專屬性、線性、系統適用性、準確度、精密度(重復性和中間精密度)、檢出限和定量限。
4. 浸出物(遷移)試驗:
針對加速、長期穩定性樣品的測試,根據NMPA藥品研發試驗記錄規定規范原始數據管理。
5. 毒理學安全性評估:
參考毒理學數據庫如DEREK, TOXNET, HSDB, TOXLINE等,由毒理學專家完成包括建模、數據庫查詢、文獻查詢、閾值計算等工作,從而得到完整的毒理學評估報告。
6. 結論:
綜合可提取物研究和浸出物研究結果,并參考毒理學評估結果,給出最終的相容性研究結論。
藥包材相容性研究流程圖

參考的國內法規如下
《化學藥品注射劑與藥用玻璃包裝容器相容性研究技術指導原則(試行)》
《化學藥品注射劑與塑料包裝材料相容性研究技術指導原則(試行)》
《化學藥品注射劑與藥用彈性體相容性研究技術指導原則(試行)》
《YBB00142002-2015藥品包裝材料與藥物相容性試驗指導原則》
《中國藥典》2015版等
PQRI
ICH Q3D
USP 1663& USP1664
USP 665& USP 1665
常見問題
包裝材料和藥品種類多樣、復雜法規要求理解不透徹,無法設計出一套完整的解決方案溶出量極低且體系復雜,儀器的高靈敏度和高選擇性并重




